第2回
成熟化iPSC由来心筋細胞は心毒性スクリーニングを
向上させることができるだろうか?
向上させることができるだろうか?
Roshini Beenukumar, PhD
心毒性は、前臨床試験、臨床試験、市販後調査に至るまで、医薬品開発プロセス全体において重要な懸念事項です。心毒性の評価には動物モデルが一般的に用いられていますが、ヒトにおける毒性を正確に予測できないことが多いため、ヒト多能性幹細胞由来心筋細胞(iPSC-CM)を用いた新しいアッセイが心毒性スクリーニングプロトコルに組み込まれつつあります。本稿では、ヒトiPSC由来心筋細胞を心毒性スクリーニングに利用することの利点と問題点を探り、iPSC由来心筋細胞の成熟化を促進する新しい細胞培養基材をご紹介します。
医薬品開発において、臨床試験での失敗は大きな代償を伴います。医薬品の失敗のほぼ半分は、動物実験や前臨床段階で検出されなかった安全性の懸念が原因となっています(1)。特に心毒性は大きな要因であり、医薬品の副作用により市場から撤退する一般的な理由となっています(2,3)。治験薬の心毒性を検出する既存の方法には限界があるため、医薬品開発プロセスにおける心毒性スクリーニングのための、より正確で包括的なモデルの必要性が強調されています(4)。
前臨床試験における心毒性スクリーニングの様々な手法の中で、動物モデルは現在でも最も広く用いられています。しかし、動物モデルは。ヒトの生理・代謝を完全に再現できないため,ヒトでの毒性予測が不正確になる可能性があります。さらに、動物、特に大型の動物を試験に使用することには倫理的な懸念があります。そこで、計算シミュレーションを用いてヒトの心臓と薬剤に対する反応をモデル化するインシリコモデリングや、iPS細胞やプライマリー心筋細胞を用いた心毒性スクリーニングアッセイなどの新しい手法の統合が進められています(4)。
ヒトiPSC由来心筋細胞は、その入手のしやすさと遺伝子操作のしやすさから、研究コミュニティだけでなく規制当局からも、心毒性スクリーニングプロトコルに追加する有望な方法として受け入れられています。国立医薬品食品衛生研究所(NIHS)、医薬品医療機器総合機構(PMDA)、米食品医薬品局(FDA)、欧州医薬品庁(EMA)、その他のグローバル規制機関のメンバーが参加するCiPA(Comprehensive in vitro Proarrhythmia Assay)コンソーシアムは、包括的なin vitro 催不整脈試験プロトコルの一部として、in vitroおよびin silico 試験の所見を確認するためのヒトiPSC由来心筋細胞試験を推奨しています(5)。
ごく最近、FDAは、前臨床医薬品試験の代替方法を歓迎し、ヒト試験の前に動物実験を行う必要がなくなったと発表しました(6)。この動きは、英国のウェルカム・サンガー研究所が2019年に、世界で最も有名なセンターの1つである動物研究施設を閉鎖すると発表したことを受けてのものです(7)。これらの歴史的な発表は、動物実験をiPSCやオルガノイドのような潜在的な代替物で置き換えるという、より広い世界的な動きを示しています。
以下に薬物毒性スクリーニングにおけるヒトiPSC由来心筋細胞の利点を挙げます(8)。
・スケーラビリティ:iPS細胞は容易にスケールアップすることができ、大規模な薬物スクリーニングのための心筋細胞の効率的かつ持続的な生産が可能です。
・患者特異性:ヒトiPSC由来心筋細胞は、患者の臨床的/遺伝的情報とin vitroでの薬理学的反応との相関を可能にするため、個別化医療へのアプローチを促進することができます。
・疾患特異性:疾患特異的なヒトiPSC由来心筋細胞のモデルは、疾患メカニズムの研究や新しい治療法のテストのためのプラットフォームとなる可能性があります。
・患者の層別化:代表的な一般集団から分化したヒトiPSC由来心筋細胞は、臨床試験のための患者の層別化を可能にします。
・患者特異性:ヒトiPSC由来心筋細胞は、患者の臨床的/遺伝的情報とin vitroでの薬理学的反応との相関を可能にするため、個別化医療へのアプローチを促進することができます。
・疾患特異性:疾患特異的なヒトiPSC由来心筋細胞のモデルは、疾患メカニズムの研究や新しい治療法のテストのためのプラットフォームとなる可能性があります。
・患者の層別化:代表的な一般集団から分化したヒトiPSC由来心筋細胞は、臨床試験のための患者の層別化を可能にします。
ヒトiPSC由来心筋細胞によるがん治療薬誘発性心毒性の研究
アントラサイクリン系薬剤、抗微小管系薬剤、チロシンキナーゼ阻害剤(TKI)、抗体医薬などのがん治療薬による心毒性は、がん治療薬の開発において依然として大きな懸念となっています(9)。iPSC由来心筋細胞、特に個々の患者細胞を分化させて得られた心筋細胞は、がん治療による心毒性の評価実験に適用、あるいは動物実験を代替できる可能性があります。例えば、様々ながんの治療に単独または他の薬剤と併用してよく用いられる抗がん剤であるドキソルビシンは、心毒性を引き起こすことが知られています。いくつかの研究では、iPSC由来心筋細胞 を用いて、ドキソルビシンによる心毒性のメカニズムを解明することに成功しています(10)。ある研究では、ドキソルビシン処理したiPSC由来心筋細胞 を用い、曝露時間や投与量の変化に伴うトランスクリプトームの変化を評価しました(11)。別の研究では、乳がん患者のiPSC由来心筋細胞 を用い、ドキソルビシンが細胞の活性酸素産生、カルシウム処理、細胞全体の酸化ストレス、そして最終的には二本鎖DNA損傷を増加させることを示しました(12)。
iPSC由来心筋細胞を用いた薬物毒性評価は有望ですが、多くの欠点があります。例えば、iPSC由来心筋細胞のアッセイと臨床経験との間に乖離が存在することです(13)。もう一つの大きな課題は、テストした薬物の反応を正確に評価することを難しくする、その未成熟性です。これらの課題を克服し、時間と費用対効果を改善するために、iPSCベースの薬物毒性スクリーニングのための新しい改良されたプロトコルが近い将来に開発される必要があります(9)。
ヒトiPSC由来心筋細胞を薬物検査に用いるには、成熟化の達成が重要です
ヒトiPSC由来心筋細胞の未成熟さは、異常な自発拍動パターン、あまり高分極していない静止膜電位、遅いアップストローク速度、短い活動電位など、その構造的・機能的限界に現れており、前臨床心毒性試験での使用には限界があります(4)。これらの制限に対処するため、長期細胞培養、電気刺激、機械的ストレス、生化学的誘導、共培養やパターン化基材を用いた3次元組織工学など、iPSC由来心筋細胞の成熟化を促進する様々な戦略が開発されてきました。これらの方法は、生体内の微小環境を模倣し、細胞の成熟化を促進することを目的としており、創薬試験や研究により適していると考えられます(14)。
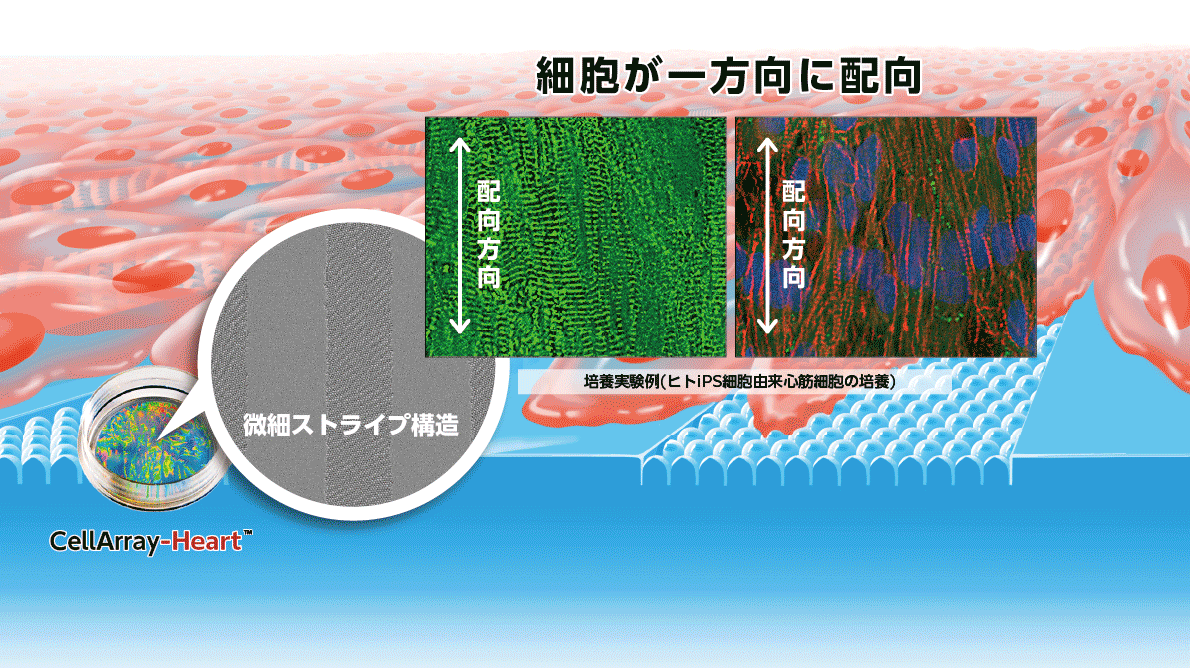
ヒトiPSC由来心筋細胞成熟化のための独創的な“微細ストライプ構造”細胞培養基材
心筋細胞の配列を制御することは、心筋組織の機能を最適化するために極めて重要です(15)。心筋細胞の整列を促進し、成熟化させるために不可欠な手段の一つが、培養基材のパターン化です。しかし、現在市販されているナノファイバースキャフォールドや単純な溝構造の基材は、細胞間の協調と配向を助長しません。そこで、細胞を基板に播種するだけでiPSC由来心筋細胞の配向培養を可能にする新しい細胞培養基材「CellArray-Heart™」が開発されました。CellArray-Heart™は、表面にナノサイズの突起と平坦な部分がストライプ状に配置されており、細胞の接着強度を変化させ、iPSC由来心筋細胞を一方向に配向させ、単一で平坦な配向性細胞シートを作製することができます。

References
1. Harrison R. K. (2016). Phase II and phase III failures: 2013-2015. Nature reviews. Drug discovery, 15(12), 817–818.
2. Onakpoya, I. J., Heneghan, C. J., & Aronson, J. K. (2016). Post-marketing withdrawal of 462 medicinal products because of adverse drug reactions: a systematic review of the world literature. BMC medicine, 14, 10.
3. Kocadal, K., Saygi, S., Alkas, F. B., & Sardas, S. (2018). Drug-associated cardiovascular risks: A retrospective evaluation of withdrawn drugs. Northern clinics of Istanbul, 6(2), 196–202.
4. Stella Stoter, A. M., Hirt, M. N., Stenzig, J., & Weinberger, F. (2020). Assessment of cardiotoxicity with stem cell-based strategies. Clinical therapeutics, 42(10), 1892–1910.
5. CiPA webpage: https://cipaproject.org/about-cipa/
5. CiPA webpage: https://cipaproject.org/about-cipa/
7. Nature new article: https://www.nature.com/articles/d41586-019-01685-7
8. Pang, L. et al. (2019). Workshop report: FDA workshop on improving cardiotoxicity assessment with human-relevant platforms. Circulation research, 125(9), 855–867.
9. Sayed, N., Ameen, M., & Wu, J. C. (2019). Personalized medicine in cardio-oncology: The role of induced pluripotent stem cell. Cardiovascular research, 115(5), 949–959.
10. Huang, M. F., Pang, L. K., Chen, Y. H., Zhao, R., & Lee, D. F. (2021). Cardiotoxicity of Antineoplastic Therapies and Applications of Induced Pluripotent Stem Cell-Derived Cardiomyocytes. Cells, 10(11), 2823.
11. Chaudhari, U. et al. (2016). Identification of genomic biomarkers for anthracycline-induced cardiotoxicity in human iPSC-derived cardiomyocytes: An in vitro repeated exposure toxicity approach for safety assessment. Archives of toxicology, 90(11), 2763–2777.
12. Burridge, P. W. et al. (2016). Human induced pluripotent stem cell-derived cardiomyocytes recapitulate the predilection of breast cancer patients to doxorubicin-induced cardiotoxicity. Nature medicine, 22(5), 547–556.
13. Blinova, K. et al. (2017). Comprehensive translational assessment of human-induced pluripotent stem cell derived cardiomyocytes for evaluating drug-induced arrhythmias. Toxicological sciences: an official journal of the Society of Toxicology, 155(1), 234–247.
14. Ahmed, R. E., Anzai, T., Chanthra, N., & Uosaki, H. (2020). A Brief Review of Current Maturation Methods for Human Induced Pluripotent Stem Cells-Derived Cardiomyocytes. Frontiers in cell and developmental biology, 8, 178.
15. Takada, T. et al. (2022). Aligned human induced pluripotent stem cell-derived cardiac tissue improves contractile properties through promoting unidirectional and synchronous cardiomyocyte contraction. Biomaterials, 281, 121351.