第3回
ヒトiPSC由来心筋細胞は“成熟化”で再生医療への導入を
加速させることができるのだろうか?
加速させることができるのだろうか?
Roshini Beenukumar, PhD
心血管疾患(CVD)は、毎年約1,790万人の命を奪っています。世界的な死因のトップであるにもかかわらず、現在の治療法では、それによって引き起こされる障害の回復には至っていません。ヒト人工多能性幹細胞(iPS細胞)などの幹細胞を用いた再生治療は、心筋の修復の可能性があります。本稿では、iPSC由来心筋細胞(iPSC-CM)を心筋再生に適用する場面や直面する課題について議論します。また、再生医療への応用を遅らせている重要な障害であるiPSC由来心筋細胞の成熟を促進するための、細胞シート技術に基づく新しいアプローチについても説明します。
心血管疾患はますます一般的になってきています。この背景には、高齢化社会の到来と医学の進歩による心血管疾患患者の寿命の延びがあります。心血管疾患は世界における主要な死因として、毎年約1790万人の命を奪っています(1)。最も一般的な心血管疾患は急性心筋梗塞(AMI)であり、毎年300万人近くが死亡しています。急性心筋梗塞生存者の約5-10%が最初の1年以内に死亡し、約半数が同じ年内に入院を余儀なくされています(2)。
急性心筋梗塞は心筋に不可逆的な損傷を与え、拡張期および収縮期の機能を弱め、不整脈を引き起こしやすくします(2)。急性心筋梗塞患者に対する標準的な治療法は、経皮的血管形成術と冠動脈バイパス術です。しかし、これらの治療法は心臓への血流を回復させることのみを目的としており、傷ついた心筋を再生させるものではありません。したがって、このアンメットニーズを満たすために、特に重症の心臓病を患っている患者に対する新しい治療戦略が必要とされています(3)。
心筋の修復に期待される再生医療アプローチ
心不全に対する幹細胞臨床試験の包括的なシステマティック・レビューとメタアナリシス(31件の無作為化対照試験と1521人の参加者を含む)が行われ、様々な細胞療法とプラセボまたはコントロールが比較されました。この研究では、幹細胞の注入による細胞療法は心不全悪化による死亡率と再入院を有意に減少させ、左室収縮機能を中等度に改善し、心不全症状、運動能力、QOLを改善すると結論付けています(4)。
このような前向きな展望にもかかわらず、虚血心臓へ直接注入された各種幹細胞の生存率の低さが、その臨床応用を妨げています。70%以上の細胞が直接注入後2日以内に死滅し、生き残った細胞はその後数日間で徐々に失われていきます(3)。
心臓再生におけるヒトiPS細胞〜成熟化のケース
胚性幹細胞(ES細胞)やiPS細胞などの多能性幹細胞は、様々な理由から心臓の再生に特に有利です。その無限の再生能力とあらゆる細胞に分化する能力により、急性心筋梗塞による損傷を補うことができます。また、iPS細胞はES細胞のような倫理的、免疫原的な懸念がなく、バンク化も可能であるため、臨床的有用性が拡大します(3)。したがって、多能性幹細胞は、胚性幹細胞に代わる再生医療への応用に有利な細胞であると言えます。
しかし、iPS細胞には限界があります。安全性を確保するため、iPS細胞を用いた技術では、潜在的に有害なゲノム変化を最小限に抑えるiPS細胞の作製と制御された分化が必要です。また、特にiPSC 由来心筋細胞において強調される欠点は、構造的・機能的に未熟であることです。形態的には、iPSC由来心筋細胞は成体心筋細胞よりも短く、丸く、薄くなっています。さらに、T管が形成されず、筋小胞体もあまり発達しておらず、単核であることが多いです。代謝と機能の面では、iPSC由来心筋細胞は胎児心筋に類似しており、ミトコンドリアの数が少ないため、脂肪酸のβ酸化の代わりに解糖をエネルギー源としています。また、成体心筋細胞よりも静止膜電位が高く、脱分極速度が遅くなっています。さらに、iPSC由来心筋細胞の遺伝子発現プロファイルは、成体心筋細胞よりもむしろ胎児心筋細胞に類似しています(5)。
iPSC由来心筋細胞の成熟化のための細胞シート技術
iPSC由来心筋細胞の成熟を促進するために、様々なストラテジーが開発されています。これらの方法は、長期の細胞培養、生化学的誘導、機械的刺激、電気刺激、共培養とパターン化された基板を用いた3次元組織工学などを含み、生体内の微小環境を模倣し、再生医療応用への適性を高めることを目的としています(6)。
細胞シート技術は、iPSC由来心筋細胞の成熟化のためのアプローチとしてますます普及しています。足場材を含まない細胞シートは、炎症反応を誘発するリスクを排除し、細胞の生存を促進します(3)。ある研究では、胚性幹細胞に由来する足場なしのヒト心臓組織パッチが、生体内移植に耐え、宿主の冠状動脈循環と統合することが示されました(7)。虚血性心不全の患者への自家骨格筋芽細胞シート移植の有効性と安全性を評価した第II相臨床試験では、細胞シート移植が参照法と比較して患者の症状を改善し、心臓死を予防することが明らかになりました(8)。
一方向性の成熟化心筋細胞シートを作製するための新規細胞培養基材の開発
一方向性の心筋細胞シートを作製するために、細胞培養基材をパターン化することは、成熟を促進するために用いられる手法の一つです(9)。しかし、ナノファイバー足場や単純な溝パターンのような一般的な基材では、細胞間の協調や整列は促進されません。ここでは、これらの制限を克服した新しい細胞培養基材、CellArray-Heart™を紹介します。CellArray-Heart™は、播種するだけで細胞の配向培養を可能にする細胞培養基材です。表面にナノサイズの突起と平坦な部分がストライプ状に配置されており、細胞の接着強度を変化させ、単一で平坦な配向性細胞シートを作製することができます。さらに、温度応答性ポリマーのコーティングにより、細胞シートを培養皿から容易に取り出すことができ、再生医療への応用が期待されます。
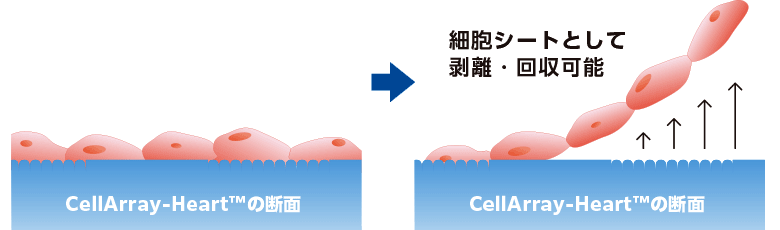
※上記はCellArray-Heart™35㎜ディッシュの表面を改質した際の実験例であり、当商品単体では培養細胞の解析が中心になります。
細胞剥離ができる商品をご要望の際は別途お問い合わせ願います。
細胞剥離ができる商品をご要望の際は別途お問い合わせ願います。

References
1. WHO webpage: https://www.who.int/health-topics/cardiovascular-diseases#tab=tab_1
2. Mechanic, O.J., Gavin, M., and Grossman, S.A. (2022) Acute myocardial infarction (Book), Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK459269/
3. Masumoto, H., & Yamashita, J. K. (2016). Human iPS Cell-Derived Cardiac Tissue Sheets: a Platform for Cardiac Regeneration. Current treatment options in cardiovascular medicine, 18(11), 65.
4. Fisher, S. A., Doree, C., Mathur, A., & Martin-Rendon, E. (2015). Meta-analysis of cell therapy trials for patients with heart failure. Circulation research, 116(8), 1361–1377.
5. Musunuru, K., Sheikh, F., Gupta, R. M., Houser, S. R., Maher, K. O., Milan, D. J., Terzic, A., Wu, J. C., & American Heart Association Council on Functional Genomics and Translational Biology; Council on Cardiovascular Disease in the Young; and Council on Cardiovascular and Stroke Nursing (2018). Induced Pluripotent Stem Cells for Cardiovascular Disease Modeling and Precision Medicine: A Scientific Statement From the American Heart Association. Circulation. Genomic and precision medicine, 11(1), e000043.
6. Ahmed, R. E., Anzai, T., Chanthra, N., & Uosaki, H. (2020). A Brief Review of Current Maturation Methods for Human Induced Pluripotent Stem Cells-Derived Cardiomyocytes. Frontiers in cell and developmental biology, 8, 178.
7. Stevens, K. R., Kreutziger, K. L., Dupras, S. K., Korte, F. S., Regnier, M., Muskheli, V., Nourse, M. B., Bendixen, K., Reinecke, H., & Murry, C. E. (2009). Physiological function and transplantation of scaffold-free and vascularized human cardiac muscle tissue. Proceedings of the National Academy of Sciences of the United States of America, 106(39), 16568–16573.
8. Imamura, T., Kinugawa, K., Sakata, Y., Miyagawa, S., Sawa, Y., Yamazaki, K., & Ono, M. (2016). Improved clinical course of autologous skeletal myoblast sheet (TCD-51073) transplantation when compared to a propensity score-matched cardiac resynchronization therapy population. Journal of artificial organs : the official journal of the Japanese Society for Artificial Organs, 19(1), 80–86.
9. Takada, T. et al. (2022). Aligned human induced pluripotent stem cell-derived cardiac tissue improves contractile properties through promoting unidirectional and synchronous cardiomyocyte contraction. Biomaterials, 281, 121351.