第1回
ヒトiPS細胞から分化誘導された心筋細胞は成熟化が必要。その理由とは?
Roshini Beenukumar, PhD

多能性幹細胞(iPSC)由来の心筋細胞は、毒性研究、疾患モデリング、心血管系疾患の治療など幅広い応用が期待されています。しかし、その普及を阻む課題として、生体組織に類似した成熟心筋細胞の作製が困難であることが挙げられています。iPS創薬、再生医療、心毒性試験においてiPSC技術の可能性を最大限に発揮するためには、医学、生物学、工学など様々な専門分野の先端技術を結集し、心筋細胞の成熟化の問題に効果的に取り組む必要があります。ここでは、現在の成熟化戦略について述べるとともに、ヒト多能性幹細胞由来心筋細胞の成熟化のための新しい「配向性」細胞培養基材をご紹介します。
心血管疾患は、年間約1790万人の命を奪い、世界の死因の第1位となっています。(1)心血管疾患の中でも急性心筋梗塞(AMI)は最も多く、年間約300万人が亡くなっています。(2) 心筋梗塞は心筋に不可逆的な損傷を与えるため、心臓移植が最も有効な治療法ですが、ドナーの不足、手術の合併症などの問題が残っています。(3)
ヒト多能性幹細胞由来心筋細胞(iPSC-CM)は、心血管疾患に対する現在の治療法に代わる有望な治療法として注目されています。心臓再生のための間葉系幹細胞(MSC)は、さまざまな臨床試験で安全性と有効性が確認されています。しかし、心筋細胞への分化が容易でなく、移植後の定着性も悪いというデメリットがあります。(3,4)
山中伸弥教授らの研究チームが開拓したiPSC技術(5)に基づく人工多能性幹細胞から分化した心筋細胞(iPSC由来心筋細胞)は、MSCと比較して、前臨床試験でより良好な心筋予後をもたらしました。(3)
iPSC由来心筋細胞の形態的・生理的な未熟さ
iPSC由来心筋細胞は、構造および機能の面で未熟な表現型を示します。特に、ミトコンドリア機能障害、大きな脱分極拡張期電位、心筋特異的およびギャップジャンクションタンパク質の弱い発現、未熟なサルコメア形成が見られ、これらはすべて移植後に不整脈を引き起こす可能性があります。(3) したがって、iPSC由来心筋細胞を臨床に応用するためには、成熟化を達成することが重要です。
iPSC由来心筋細胞の成熟を促進するために、いくつかの戦略が開発されています。それらは、長期の細胞培養、電気刺激、機械的ストレス、生化学的誘導、そして共培養、細胞外マトリックス(ECM)、生体適合材料を用いた3次元組織工学などです。これらの取り組みが功を奏しているとはいえ、まだまだ改善の余地があります。(6)
成熟化を目的とした細胞培養基材のパターニング
この分野での重要なアンメットニーズは、成熟を促す環境を作り出すための細胞培養の標準化にあります。細胞培養の中で細胞が経験する物理的な刺激は心筋細胞の分化の自然なプロセスを模倣することが求められ、培養基材のパターニングは、成熟のための不可欠なツールです。しかし、iPSC由来心筋細胞の成熟を促進するために現在使用されている一般的な平板の基材および特殊な構造や素材からなる細胞培養基材は、細胞間の協調を促進するものではありません。例えば、ナノファイバーを足場とした基板では、細胞が繊維部分に付着してしまい、単純な溝構造の基板では、高低差のために細胞の協調が阻害されてしまいます。
そこで、これらの問題を克服し、播種するだけでiPSC由来心筋細胞の配向性培養を可能にする新しい細胞培養基材、「CellArray-Heart™(セラレイ・ハート)」をご紹介します。
心筋細胞の成熟を促す配向性細胞培養
CellArray-Heart™は、心筋細胞を一方向に整列させる表面微細構造を持つ細胞培養基材です。CellArray-Heart™シリーズの細胞培養用ディッシュやマルチウェルプレートには、ナノサイズの突起と平坦な部分がストライプ状に配置されています。この微細ストライプ構造により、細胞の接着強度が変化するため、iPSC由来心筋細胞を一方向に配向させ、単一で平坦な配向性細胞シートを作製することができます。さらに、温度応答性ポリマー等を加工する事により、細胞シートを培養皿から容易に取り出すことができ、再生医療研究への応用が期待されます。

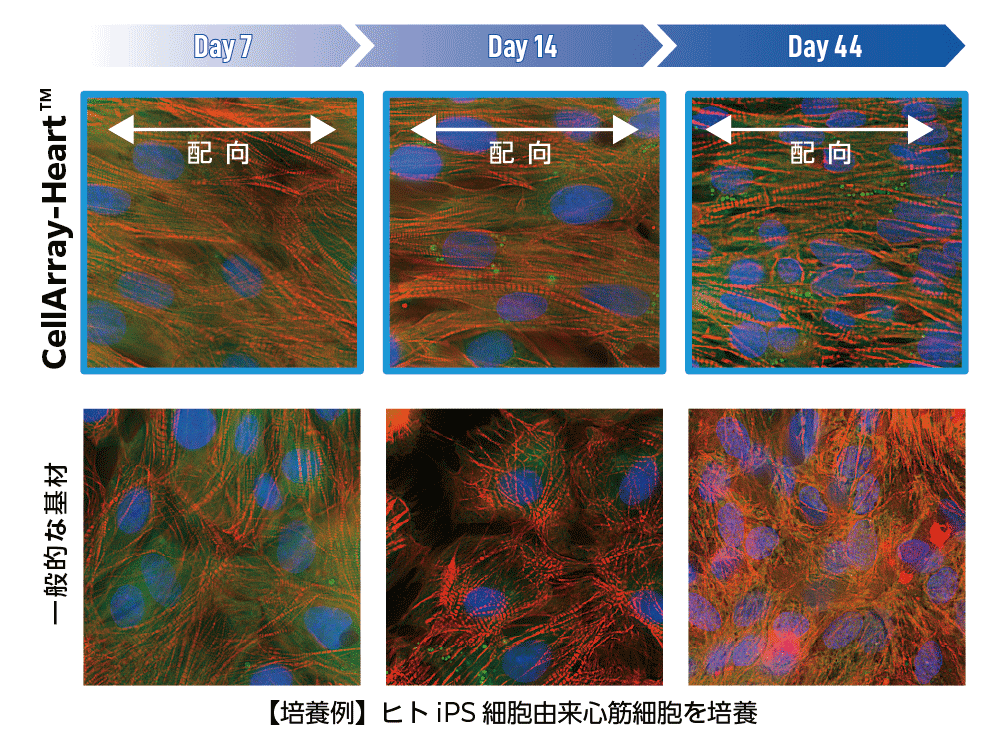
CellArray-Heart™で培養したヒトiPSC由来心筋細胞は、どれくらいの期間配向性を維持しますか?
この質問に答えるため、CellArray-Heart™上で細胞培養後、7、14、44日目に観察を行い、通常の平面基材上で培養したヒトiPSC由来心筋細胞と比較しました。CellArray-Heart™上で培養したiPS心筋細胞は、44日目まで細胞が配向した状態を維持しました。一方、通常の平面基板上で培養した細胞は、培養日数に関係なくランダムな向きを示しました。(Figure 1)
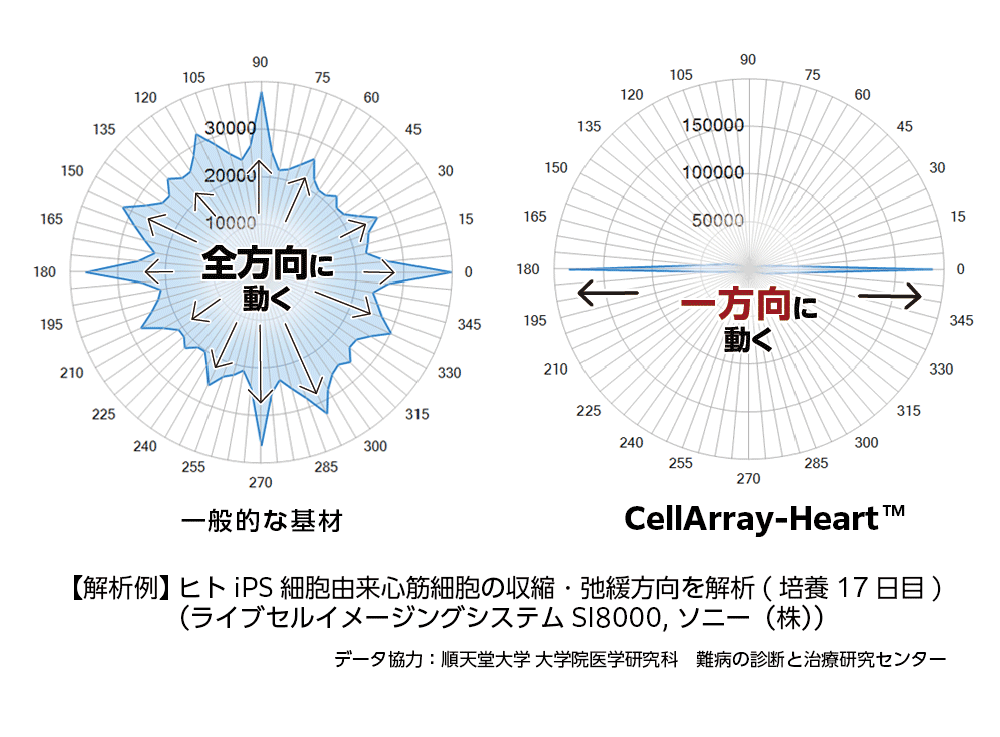
CellArray-Heart™は心筋細胞の機能にどのような影響を与えるのでしょうか?
CellArray-Heart™上で培養した心筋細胞と、通常の平面基材上で17日間培養した心筋細胞の運動性を、ライブセルイメージングシステムを用いて比較したところ、CellArray-Heart™上で培養した心筋細胞は、180°と0°の角度で一方向に収縮・弛緩し、ストライプの方向と一致することが示されました。一方、平面基材上で培養した心筋細胞は、あらゆる方向に運動性を示し、収縮と弛緩の方向性がランダムであることが示されました。(Figure 2)
構造や電気生理、機能において成体心筋細胞に類似した成熟したiPSC由来心筋細胞を得ることは、多くの研究者にとって依然として困難な状況です。しかし、CellArray-Heart™を用いた配向性細胞培養の導入により、成体心筋細胞レベルの成熟を達成することはもはや不可能ではありません。
参考文献
1. WHO webpage: https://www.who.int/health-topics/cardiovascular-diseases#tab=tab_1
2. Mechanic, O.J., Gavin, M., and Grossman, S.A. (2022) Acute myocardial infarction (Book), Treasure Island (FL): StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK459269/
3. Wu, P., Deng, G., Sai, X., Guo, H., Huang, H., & Zhu, P. (2021). Maturation strategies and limitations of induced pluripotent stem cell-derived cardiomyocytes. Biosci. Rep. 41(6), BSR20200833. https://doi.org/10.1042/BSR20200833
4. Trounson, A., & McDonald, C. (2015). Stem cell therapies in clinical trials: Progress and challenges. Cell stem cell, 17(1), 11–22. https://doi.org/10.1016/j.stem.2015.06.007
5. Takahashi, K. & Yamanaka, S. (2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4): 663–76. https://doi:10.1016/j.cell.2006.07.024
6. Ahmed, R. E., Anzai, T., Chanthra, N., & Uosaki, H. (2020). A brief review of current maturation methods for human induced pluripotent stem cells-derived cardiomyocytes. Front. Cell Dev. Biol. 8, 178. https://doi.org/10.3389/fcell.2020.00178
7. Abadi, P.P.S.S. et al. Engineering of mature human induced pluripotent stem cell-derived cardiomyocytes using substrates with multiscale topography. Adv. Funct. Mater. 28:1707378. https://doi.org/10.1002/adfm.201707378